Ikatan kovalen adalah ikatan tidak terjadi transfer elektron, tetapi atom- atomnya menggunakan pasangan elektron valensinya bersama-sama. Kovalen biasanya digambarkan dengan titik-titik yang mewakili pasangan elektron yang digunakan bersama, atau dengan suatu garis.
Ikatan kovalen yang terbentuk pada molekul hidrogen hanya melibatkan satu pasangan elektron atau dua buah elektron, sehingga disebut juga sebagai kovalen tunggal. Contohnya terjadi pada gas fluor dan gas klor.
Gas-gas yang kita temukan di alam, seperti hidrogen, nitrogen, oksigen, berada dalam bentuk molekulnya: H2, N2, dan O2. Sebagai atom tunggal, unsur-unsur ini sangat reaktif, sehingga membentuk molekul untuk mencapai konfigurasi elektron yang stabil.
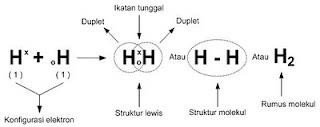
Contohnya adalah molekul hidrogen (H2).
Atom H hanya mempunyai 1 e–, perlu tambahan 1 e– agar menjadi seperti He. Jika 2 atom H berdekatan, keduanya dapat menggunakan 2 e– yang ada secara bersama, sehingga masing-masing atom H menjadi seperti He. 2 e– tersebut menarik kedua atom H untuk berikatan menjadi molekul H2. Sehingga terbentuk ikatan kovalen.
Ikatan yang terjadi pada oksigen dan nitrogen sedikit berbeda. Oksigen memiliki enam elektron pada kulit terluarnya sehingga memerlukan dua elektron tambahan untuk mencapai konfigurasi yang stabil. Dua atom oksigen akan menggunakan dua pasangan elektronnya bersama-sama untuk membentuk kovalen rangkap dua.
Nitrogen memerlukan tiga elektron untuk mencapai konfigurasi elektron yang stabil. Dua atom nitrogen harus menggunakan tiga pasangan elektronnya besama-sama dan membentuk kovalen rangkap tiga. Unsur-unsur yang berbeda dapat juga berikatan secara kovalen. Contohnya HCl dan air, (H2O).
Ikatan Kovalen Koordinasi

Pasangan elektron yang digunakan untuk berikatan berasal dari salah satu pihak. Jika pasangan elektron yang digunakan bersama hanya berasal dari salah satu atom saja, maka terbentuk ikatan kovalen koordinasi.
Ion ammonium dan ion hidronium masing-masing mengandung satu kovalen koordinasi. Ion hidronium, H3O+ dibentuk dari molekul air yang mengikat ion hidrogen melalui reaksi: H2O + H+ H3O+. Struktur Lewisnya ditulis sebagai berikut.

Pada molekul H2O, atom oksigen mempunyai dua pasang elektron bebas. H+ tidak mempunyai elektron. Untuk membentuk ikatan digunakan salah satu pasangan elektron bebas dari oksigen sehingga terbentuk kovalen koordinasi. Ikatan ini bisa dituliskan sebagai berikut.
Tanda panah (→) menunjukkan pasangan elektron kovalen koordinasi berasal dari atom oksigen. Ion amonium, NH + dibentuk dari NH dan ion H+ melalui reaksi: NH3 + H+ → NH4+.
Struktur Lewisnya ditulis sebagai berikut


Pasangan elektron kovalen koordinasi berasal dari atom nitrogen.
Suatu senyawa dapat sekaligus mengandung berikatan secara ionik dan/atau kovalen. Contoh: senyawa natrium asetat. Ikatan antara natrium dan ion asetat adalah ikatan ion, sedangkan reaksi yang terjadi antara karbon, hidrogen, dan oksigen dalam gugus asetat adalah kovalen.

Ikatan kovalen terdiri atas kovalen polar dan non polar. Berikut ini akan diuraikan mengenai kedua ikatan tersebut.
Ikatan Kovalen Polar dan Nonpolar
Suatu senyawa mempunyai jenis ikatan yaitu ionik, kovalen polar, dan nonpolar. Kovalen polar ditentukan oleh selisih harga keelektronegatifan antar unsur yang berikatan.
Atom dengan keelektronegatifan yang sama atau hampir sama membentuk kovalen nonpolar. Molekul-molekul organik, ikatan C-C dan ikatan C-H adalah jenis ikatan nonpolar.
Contoh ikatan pada molekul Br2
Senyawa kovalen seperti HCl, CO, H2O, CH3OH, atau H2C=O, salah satu atomnya mempunyai keelektronegatifan yang lebih besar daripada yang lainnya. Akibatnya, ikatan yang terbentuk memiliki distribusi rapat elektron yang tidak merata. Ini disebut kovalen polar.

Ikatan Kovalen Logam
Kawat tembaga digunakan sebagai penghantar listrik dalam kabel, besi digunakan untuk setrika sebagai penghantar panas, dan emas atau perakdigunakan untuk perhiasan dalam bentuk yang indah.
Apa penyebab logam memiliki sifat tersebut?
Hal ini disebabkan atom- atom pada logam tersebut tidak berdiri sendiri-sendiri tetapi bergabung melalui ikatan logam.

Atom logam mempunyai keelektronegatifan rendah, artinya mereka cenderung mudah melepaskan elektron terluarnya. Jika atom logam melepaskan elektron maka terbentuk kation atau ion positif. Berdasarkan sinar X, logam- logam membentuk kisi kristal. Struktur kisi logam tersusun dalam kation-kation.
Elektron- elektron dari atom logam ditemukan di dalam kisi-kisi logam dan bebas bergerak di antara semua kation, membentuk lautan elektron. Gaya elektrostatik antarmuatan (+) logam dan muatan (–) dari elektron akan menggabungkan kisi- kisi logam tersebut.
Tarik-menarik dari kation di dalam lautan elektron yang bertindak sebagai perekat dan menggabungkan kation-kation disebut ikatan logam.
Mengapa logam dapat menghantarkan listrik?
Elektron yang bebas bergerak pada lautan elektron menyebabkan logam dapat meng hantarkan listrik sehingga logam banyak digunakan sebagai penghantar listrik dalam kabel. Logam pada umumnya titik didihnya tinggi, penghantar panas yang baik dan dapat ditempa.
Atom logam dengan atom logam tersusun rapat membentuk struktur raksasa sehingga logam mempunyai titik leleh dan kekerasan yang tinggi.
Dengan demikian, logam banyak digunakan sebagai penghantar panas. Ada logam yang mudah dibentuk dengan ditempa maka logam banyak digunakan untuk perhiasan atau pajangan dengan bentuk yang indah.
Simpulan:
- Ikatan kovalen terjadi karena dua elektron (satu pasang) digunakan secara bersama oleh dua atom. Dalam banyak ikatan kovalen, dua atau tiga pasang elektron dibagi oleh dua atom.
- Beberapa atom yang terikat secara kovalen juga memiliki pasangan elektron bebas, yaitu pasangan elektron valensi yang tidak terlibat dalam ikatan.















